Periyodik Cetvel
- Periyodik cetvel elementlerin kimyasal ve fiziksel özelliklerini periyodik olarak gösteren çizelge. Elementlerin fiziksel ve kimyasal özelliklerindeki benzerliklerin araştırılması fizik ve kimyacıları ilgilendirmiştir. Gerçi benzer özelliklerdeki elementlerin sıralanabilmesi için bilinen elementlerin özelliklerinin öncelikle ortaya konulması gerekir. Altın, gümüş, kalay, bakır, kurşun ve cıva gibi elementler eski çağlardan beri biliniyordu.
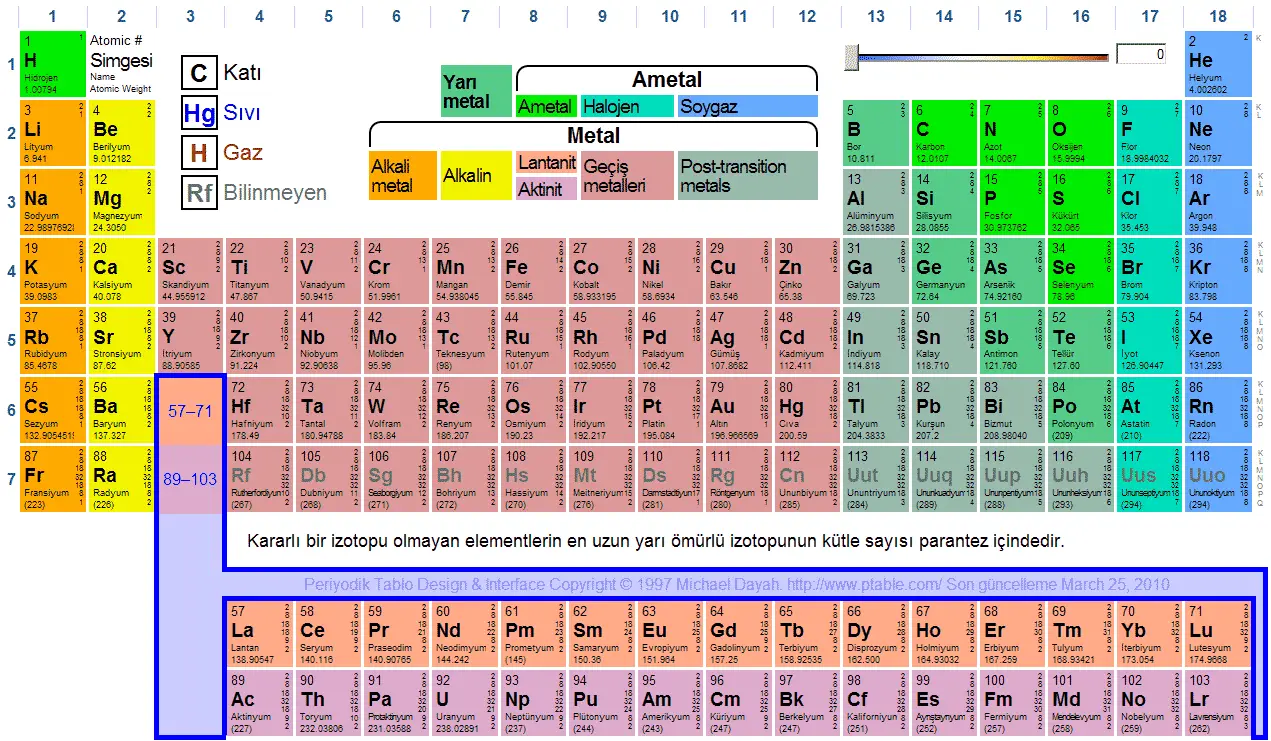
- Periyodik cetvel elementlerin elektron dizilişine bağlı olarak dört bloktan meydana gelir. Cetvelde yatay sütunlara periyot, düşey sütunlara grup denir.Periyodik cetvel 7 periyot ile 8A, 8B grubu olmak üzere 16 gruptan oluşur. 4. ve 5. periyotlarda periyodun 10 element uzamasına d orbitalinin dolması neden olur. 6. ve 7. periyotlarda ise sıranın 14 element uzamasına f orbitalinin dolması neden olur. F orbitaline elektron dolan 14 elementten 6. sıradaki lantanitler ve 7. sıradaki aktinitler, cetvelin daha fazla uzamaması için alt sırada f bloğuna alınmıştır.
- Periyodik cetvelin s bloğunda IA ve IIA, p bloğunda IIIA, IVA, VA, VIA, VIIA ve 0 grupları, d bloğunda ise IIIB, IVB, VB, VIB, VIIB, VIIIB, IB ve IIB grupları yer alır.
- Elementler artan atom numaralarına göre periyodik cetvele yerleştirildiğinde, cetvelin sol tarafında metallerin sağ tarafında ametallerin yer aldığı görülür.
Ana Özellikleri:(Görünüm Özellikleri)
1- Periyodik cetvel 4 ana bloktan oluşmuştur; s, p, d ve f
2- Periyodik cetvelde, her biri bir enerji seviyesine karşılık gelen 7 tane periyot (satır) vardır.
3- Periyodik cetvelde 8 tane A ve 8 tane B olmak üzere toplam 16 tane GRUP var. Ancak 8B grubu 3 sütundan oluşmuştur.
4- Birinci periyot hariç her periyot bir alkali metal ile başlar. Her periyot bir soy gaz ile biter. (IA grubundaki H aslında başlı başına bir gruptur. Ancak bir çok özelliği IA''ya yakın olduğundan bu grupta gösterilir.)
5- B gruplarının genel adı GEÇİŞ ELEMENTLERİ olarak adlandırılır.
6- Periyodik cetvelin altındaki f bloğu ise İÇ GEÇİŞ ELEMENTLERİ olarak adlandırılır. Alt grupları ise LANTANİTLER ve AKTİNİTLERDİR
7- Metaller ve a-Metaller
8- Periyodik cetvelin;
1. PERİYOTTA = 2 ELEMENT2. PERİYOTTA = 8 ELEMENT
3. PERİYOTTA = 8 ELEMENT
4. PERİYOTTA = 18 ELEMENT
5. PERİYOTTA = 18 ELEMENT
6. PERİYOTTA = 32 ELEMENT
7. PERİYOTTA = 32 ELEMENT
Bulunur. Ayrıca Lantanit ve Aktinit serisinde de 14''er element bulunur. Bunlar 6 ve 7. periyot elementlerindir
(Kimyasal Özellikleri)SOLDAN → SAĞA doğru
1. Atom numarası artar.
2. Kütle numarası artar
3. Değerlik elektron sayısı artar.
4. İyonlaşma enerjisi artar.
5. Ametalik özellik artar.
a) Elektron alma isteği artar.b) Oksitli bileşiklerinin sulu çözeltisinde asit özelliği artar.
c) Hidrojenli bileşiklerinde asit özelliği artar.
d) Ametalik aktiflik artar.
6. Son enerji seviyesi değişmez.7. Atom hacmi azalır.
